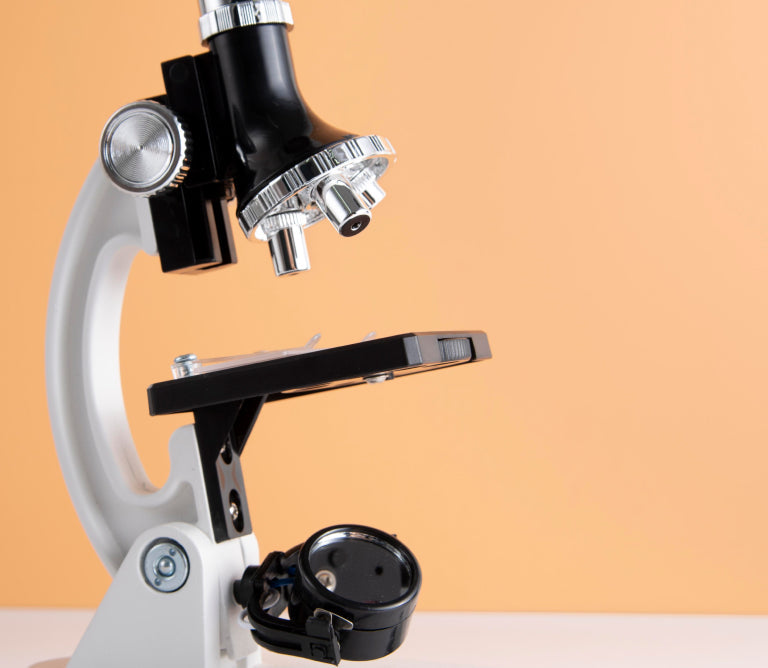
لاختبار كل هذا، نحتاج إلى تقنية علمية يمكنها تتبع ما يحدث داخل المحلول على المستوى النانوي. وهنا يأتي دور مجهر تشتت الضوء الديناميكي، أو DLS اختصارًا. على الرغم من اسمه المخيف، إلا أن هذه الطريقة أنيقة للغاية في بساطتها: يتم إرسال شعاع ليزر صغير عبر عينة سائلة تحتوي على الليبوزومات، ويتم جمع الضوء المتناثر منها بزاوية ثابتة. ولأن الليبوزومات تتحرك باستمرار في حركة عشوائية تسمى "الحركة البراونية"، فإن الضوء المتناثر يتغير باختلاف سرعتها. كلما صغر حجم الجسيمات، زادت سرعتها، والعكس صحيح. يسمح لنا هذا بحساب الحجم الهيدروديناميكي لتلك الجسيمات، وهو في الأساس حجمها مع طبقة الماء المحيطة بها.
ما ستحصل عليه في النهاية هو قيمة عددية لمتوسط حجم الليبوزومات، بالإضافة إلى مقياس لمدى تجانس التركيبة، أي ما إذا كانت جميع الليبوزومات متشابهة في الحجم، أو ما إذا كان هناك مزيج من أحجام مختلفة. بمجرد البدء بتتبع هذه القيم بمرور الوقت، يمكنك معرفة الكثير: إذا زاد الحجم فجأة، فقد تندمج الليبوزومات؛ وإذا انخفض، فقد تتفكك؛ وإذا زاد التشتت، فهذه علامة على فقدان النظام لتجانسه. هذه كلها مؤشرات على وجود مشاكل في استقرار التركيبة، مما قد يؤثر بشكل مباشر على بيولوجيا المنتج وسلامته وفعاليته.
لا يُعدّ التصوير المقطعي بالتجميد العميق (DLS) الطريقة الوحيدة عالميًا لقياس الثبات، ولكنه من أكثرها سهولةً وانتشارًا. فهو سريع، ولا يتطلب إتلاف العينة، ويوفر معلومات قيّمة في وقت قصير. إلا أن له حدودًا: فهو لا يحصل على صورة حقيقية لليبوزومات (لهذا الغرض، توجد أجهزة أخرى تعمل بمبادئ مختلفة)، بل يحصل على بيانات إحصائية فقط؛ وهو حساس جدًا للشوائب الصغيرة والفقاعات وبقايا البروتين (والتي تُعامل جميعها كما لو كانت جسيمات وتُقاس أيضًا)؛ ويصعب أحيانًا التمييز بين نوعين مختلفين من الجسيمات إذا كان حجمها متقاربًا جدًا. لذلك، من الشائع دمج التصوير المقطعي بالتجميد العميق (DLS) مع طرق إضافية، أبرزها المجهر الإلكتروني بالتجميد العميق (Cryo-TEM)، الذي يُعطي صورة حقيقية لليبوزومات نفسها، ويسمح برؤية بنيتها وطبقاتها وشكلها العام. يُعطي دمج الطريقتين صورة كاملة: ما يحدث مع متوسط حجم الليبوزومات في المجموعة السكانية بأكملها، وكيف تبدو الليبوزومات نفسها، واحدة تلو الأخرى.
تدعم العديد من الدراسات هذا النهج. على سبيل المثال، أظهرت ورقة بحثية نُشرت في ACS Langmuir في عام 2023 كيف تمكنت مراقبة DLS الدقيقة على مدار عام من اكتشاف تغييرات صغيرة في استقرار الليبوزومات التي تحتوي على أدوية حساسة، حتى عندما لم تكن هناك تغييرات مرئية للعين المجردة. قارنت دراسة أخرى، نُشرت في Molecular Pharmaceutics ، قياسات DLS وصور Cryo-TEM لتركيبة Doxil®، وهي ليبوزوم دوائي معتمد، وأظهرت كيف تسبب التغيير في تكوين الليبوزوم بعد تحميل الدواء في تغيير في الشكل لم يتم اكتشافه بواسطة DLS وحده. لخصت مقالة مراجعة نُشرت في Pharmaceutics في عام 2023 عشرات الأعمال في هذا المجال وأكدت على أهمية قياسات تشتت الجسيمات كمقياس غير مباشر ليس فقط للاستقرار ولكن أيضًا لجودة الامتصاص والتوافر البيولوجي للليبوزومات في الاستخدام الغذائي والصيدلاني.
في الختام، المجهر الديناميكي ليس مجرد أداة تقنية، بل هو عين علمية تتعمق فيما يحدث على المستوى النانوي. يمكنه تحديد ما إذا كان الليبوزوم المُحضّر اليوم سيصمد حتى وصوله إلى الرف، وما إذا كان سيظل فعالاً بعد شهرين في الثلاجة أو عامين في المستودع. في عالم يبحث فيه المستهلكون عن الجودة والعلم والشفافية، وفي ظل تزايد استخدام الليبوزومات كوسيلة نقل قياسية، يُعدّ هذا المجهر أداةً أساسية. كجزء من الإجراءات الداخلية لشركة سيكويا، يُستخدم المجهر الديناميكي لمراقبة تحضير منتجاتنا في مراحلها المختلفة، بدءًا من البحث الأولي، مرورًا بالتطوير، ووصولًا إلى التحقق من ثباته ومدة صلاحيته بعد أشهر عديدة من تحضير الليبوزومات.
مصادر
-
داناي، م. وآخرون (2018). "تأثير حجم الجسيمات ومؤشر تعدد التشتت على التطبيقات السريرية لأنظمة الناقلات النانوية الدهنية." مجلة المستحضرات الصيدلانية ، 10(2)، 57.
-
بارينهولز، ي. (2012). "دوكسيل® - أول دواء نانوي معتمد من إدارة الغذاء والدواء الأمريكية: الدروس المستفادة". مجلة الإطلاق المُتحكم به ، 160(2)، 117-134.
-
سيركومب، ل. وآخرون (2015). "التطورات والتحديات في توصيل الأدوية بمساعدة الليبوزوم". مجلة فرونتيرز إن فارماكولوجي ، 6، 286.
كُتب هذا المقال من قِبل فريق سيكويا لابز بهدف تبسيط المبادئ العلمية لتقنية الليبوسومات وجعلها في متناول الجميع. نؤمن بالمعرفة والوضوح والنتائج.